Gelieerd onderzoekgroepsleider: Dr. Claudia Rössig
Immunotherapie met T-cellen die zijn ontwikkeld om kankercellen te herkennen via chimere antigeenreceptoren (CAR's) heeft een indrukwekkende klinische werkzaamheid laten zien tegen leukemieën. Bij solide tumoren belemmeren een gebrek aan adequate doelantigenen en barrières in de tumormicroomgeving samen de werking van CAR T-celtherapieën.
We streven ernaar effectieve combinatorische strategieën te ontwikkelen om de werkzaamheid van CAR T-cellen tegen verschillende pediatrische solide tumoren te verbeteren.

In een geavanceerd project dat nu dicht bij klinisch onderzoek staat, worden T-cellen ontwikkeld om een CAR tot expressie te brengen met geïntegreerde secretie van IL-18, een sterke functionele versterker van T-celfuncties en modulator van het myeloïde tumorcelcompartiment, voor lokale toediening op de plaats van de tumor. Onze hoofdkandidaat is gericht tegen de oppervlaktekanglioside GD2, die tot expressie komt in de meeste neuroblastomen en sommige osteosarcomen en Ewing-sarcomen, maar toekomstige met IL-18 versterkte CAR T-cellen zullen aanvullende antigeenherkenningsdomeinen hebben om het spectrum van behandelbare kinderkankers uit te breiden.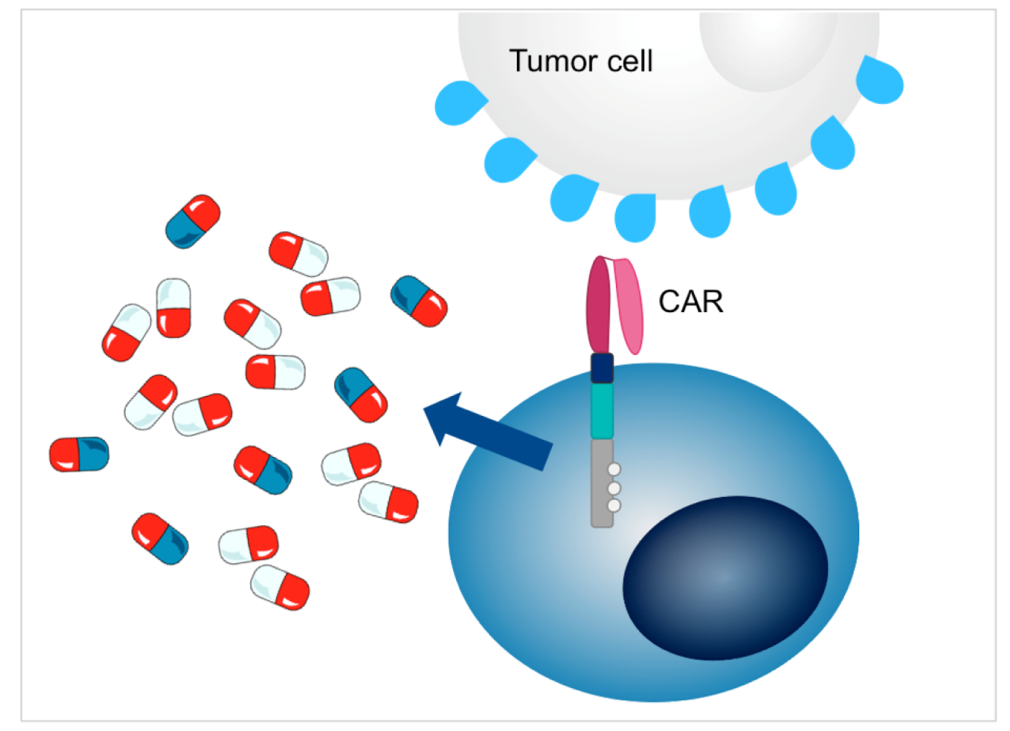
Nieuwe engineeringstrategieën met één vector geven CAR T-cellen extra therapeutische werkingsmechanismen, voor synergetische effecten binnen de tumorniche en eliminatie van tumorcellen met een lage doelexpressie.
In het algemeen zetten we stappen om nieuwe CAR T celtherapieën te vertalen naar academische klinische studies bij kinderen in heel Europa. Academische productie van gemanipuleerde T cel producten met gedecentraliseerde levering zal een sleutel tot succes zijn.
Fischer-Riepe L*, Kailayangiri S*, Zimmermann K*, Pfeifer R*, Aigner M*, Altvater B, Kretschmann S, Völkl S, Hartley J, Dreger C, Petry K, Bosio A, von Döllen A, Hartmann W, Lode H, Görlich D, Mackensen A*, Jungblut M*, Schambach A*, Abken H*, Rossig C*. *Have contributed equally. Preclinical development of CAR T cells with antigen-inducible IL-18 enforcement to treat GD2-positive solid cancers. Clin Cancer Res, accepted for publication. (IF 13.801)
Rossig C, Pearson AD, Vassal G, Scobie N, Bird N, Blanc P, Vormoor HJ, Calkoen FG, Locatelli F, del Bufalo F, Rives S, Jacoby E, Balduzzi A, Bourquin JP, Baruchel A. CAR T cell products for pediatric cancers: Why alternative development paths are needed. J Clin Oncol. 2024 Jan 20;42(3):253-257. doi: 10.1200/JCO.23.01314 (IF 45.3)
Altvater B*, Kailayangiri S*, Spurny C, Flügge M, Meltzer J, Greune L, Urban K, Schwöppe, C, Brand C, Schliemann C, Hintelmann H, Harrach S, Hartmann W, Abken H, Kuehle J, Schambach A, Görlich G, Berdel WE*, Rossig C* (* contributed equally). CAR T cells as micropharmacies against solid cancers: Combining effector T-cell mediated cell death with vascular targeting in a one-step engineering process. Cancer Gene Ther 2023, https://doi.org/10.1038/s41417-023-00642-x (IF 5.854)
Meissner, R., Wixler, V., Wulfert, F.P., Jacob, J.C., Hale, B.G., Robeck, T., Masemann, D., Boergeling, Y., and Ludwig, S. (2023). Replication-incompetent influenza A viruses armed with IFN-γ effectively mediate immune modulation and tumor destruction in mice harboring lung cancer. Mol Ther Oncolytics 31, 100741. 10.1016/j.omto.2023.100741.
Pearson ADJ*, Rossig C*, Mackall C*, Shah NN*, Baruchel A*, et al. *Joint first authors. Paediatric Strategy Forum for Medicinal Product Development of CAR T-cells in children and adolescents with cancer. ACCELERATE in collaboration with the European Medicines Agency with participation of the Food and Drug Administration. Eur J Cancer 2022 Jan;160:112-133 (IF 9.162)
Altvater B, Kailayangiri S, Pérez Lanuza LF, Urban K, Greune L, Flügge M, Meltzer J, Farwick N, König S, Görlich D, Hartmann W, Rossig C. HLA-G and HLA-E immune checkpoints are widely expressed in Ewing sarcoma but have limited functional impact on the effector functions of antigen-specific CAR T cells. Cancers 2021;13(12):2857 (IF 6.639)
Kailayangiri S, Altvater B, Lesch S, Balbach S, Göttlich C, Kühnemundt J, Mikesch JH, Schelhaas S, Jamitzky S, Meltzer J, Farwick N, Greune L, Fluegge M, Kerl K, Lode HN, Siebert N, Müller I, Walles H, Hartmann W, Rossig C. EZH2 inhibition in Ewing sarcoma upregulates GD2 expression for targeting with gene-modified T cells. Mol Ther 2019;27(5):933-946
Kailayangiri S, Altvater B, Spurny C, Jamitzky S, Schelhaas S, Jacobs AH, Wiek C, Roellecke K, Hanenberg H, Hartmann W, Wiendl H, Meltzer J, Farwick N, Greune L, Rossig C. Targeting Ewing sarcoma with activated and GD2-specific chimeric receptor-engineered human NK cells induces upregulation of immune-inhibitory HLA-G. Oncoimmunology 2016;6(1):e1250050 (IF 7.719)








