
Onderzoekgroepsleider: Dr. Jarno Drost

Kanker is nog steeds een van de belangrijkste oorzaken van ziektegerelateerde sterfgevallen bij kinderen. Overlevenden hebben last van bijwerkingen van de, in de meeste gevallen, intensieve behandelingen. Daarom is er dringend behoefte aan de ontwikkeling van verbeterde, minder toxische therapieën. Onze visie is dat als we de processen begrijpen die ten grondslag liggen aan de ontwikkeling van kinderkanker, we betere genezingspercentages en een betere kwaliteit van leven kunnen realiseren. Therapeutische innovatie wordt echter belemmerd door het gebrek aan celmodellen die representatief zijn voor natuurlijk tumorweefsel. Wij zijn ervan overtuigd dat we door het ontwikkelen van kankermodellen die de tumor van het kind beter nabootsen, preklinische bevindingen efficiënter kunnen vertalen naar de klinische praktijk en de kloof tussen laboratorium en ziekenhuisbed kunnen overbruggen: betere modellen, meer kennis, meer genezingen!
Organoïden als representatieve modellen voor solide tumoren bij kinderen
De organoïdentechnologie heeft een revolutie teweeggebracht in het kankeronderzoek, omdat deze technologie het mogelijk maakt om gezond en ziek weefsel van individuele patiënten ‘onbeperkt’ te kweken in een petrischaal, met behoud van de essentiële kenmerken van het oorspronkelijke weefsel. Organoïden worden daarom gezien als avatars van het weefsel waaruit ze zijn afgeleid. De Drost-groep was een pionier in het gebruik van organoïdentechnologie voor onderzoek naar kinderkanker. We zijn erin geslaagd om kweekprotocollen op te stellen voor het kweken van organoïden uit een breed spectrum van pediatrische maligniteiten, zoals Wilms-tumoren, niercelcarcinomen en verschillende subtypes van rhabdoïde tumoren en wekedelensarcomen. We gebruiken deze modellen om de zeer fundamentele processen te bestuderen die ten grondslag liggen aan tumorontwikkeling (zie hieronder), maar ook voor meer translationele onderzoeksprojecten. We gebruiken de organoïden bijvoorbeeld als platform voor het screenen van geneesmiddelen om tumorspecifieke kwetsbaarheden voor geneesmiddelen te vinden, maar we ontwikkelen ook co-cultuursystemen van organoïden en verschillende soorten immuuncellen om het gebruik van immuuntherapie bij kinderkanker te onderzoeken.
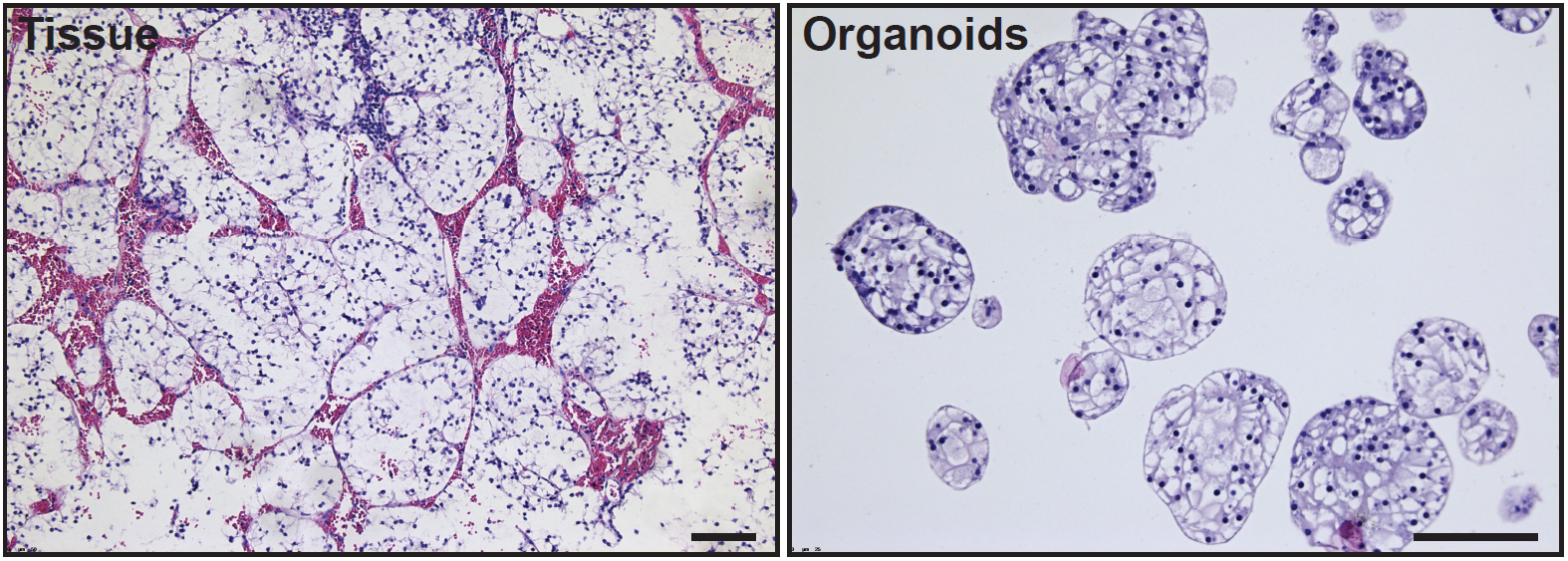
H&E kleuringen op heldere cellen met niercelkanker (links) en organoïden die daarvan gekweekt zijn (rechts).
Het ontrafelen van de ontwikkelingsgeschiedenis van kinderkanker
Veel tumoren bij kinderen ontstaan al tijdens de ontwikkeling van de foetus, maar de cellulaire oorsprong ervan blijft in veel gevallen onbekend. Het achterhalen van de cel van oorsprong van de tumor zal belangrijke aanwijzingen opleveren over de oorzaak van de ontwikkeling ervan, bijvoorbeeld een blokkade in de differentiatie. Het farmacologisch opheffen van een dergelijke blokkade zou een aantrekkelijke therapeutische interventie zijn (de zogenaamde maturatietherapie).
Om de oorsprong van tumoren te vinden, maken we gebruik van verschillende benaderingen. Ten eerste passen we DNA-sequencingtechnologieën toe om fylogenetische relaties te vinden tussen tumoren en normaal weefsel van hetzelfde individu. Hiervoor gebruiken we somatische mutaties als ‘barcodes’ om de oorsprong van de tumor te traceren. Ten tweede maken we gebruik van (single-cell) transcriptoom- en epigenoomsequencingbenaderingen, aangezien wij en anderen hebben aangetoond dat embryonale tumoren in grote mate de kenmerken van hun oorspronkelijke cellen weerspiegelen. Door tumor-transcriptoom met het transcriptoom van foetale weefselontwikkeling te vergelijken, willen we de cellulaire identiteit van de tumor ontrafelen.
Onderzoek naar de (epigenetische) processen die tumorinitiatie en -progressie aansturen
De pediatrische kankerorganoïdemodellen die we hebben ontwikkeld, bieden ons een unieke kans om de processen te bestuderen die tumorinitiatie, -progressie en therapieresistentie aansturen. We zijn met name geïnteresseerd in de epigenoomveranderingen die optreden in pediatrische tumoren die uniek worden gedefinieerd door mutaties in leden van het SWI/SNF-complex. Door tumororganoïden te combineren met genbewerkingstechnologieën en (single-cell) omics-uitlezingen, willen we de tumorbevorderende signaalroutes identificeren die als therapeutische doelwitten kunnen dienen. Bovendien hebben we orthotope organoïde xenotransplantaatmodellen en barcode-afstammingsvolgstrategieën ontwikkeld waarmee we de klonale dynamiek tijdens de verschillende stappen van tumorontwikkeling (zoals primaire tumorgroei, metastasevorming en therapieresistentie) in detail kunnen bestuderen.
Naast tumororganoïden gebruiken we ook organoïden afkomstig van gezond weefsel voor het genereren van tumormodellen. We passen verschillende genoombewerkingstechnologieën (zoals CRISPR/Cas9-technologie) toe op gezonde organoïden om tumorprogressiemodellen te genereren. Dergelijke gemanipuleerde tumororganoïden bieden genetisch gedefinieerde modellen waarmee de bijdrage van specifieke genetische veranderingen aan tumorontwikkeling kan worden bestudeerd.
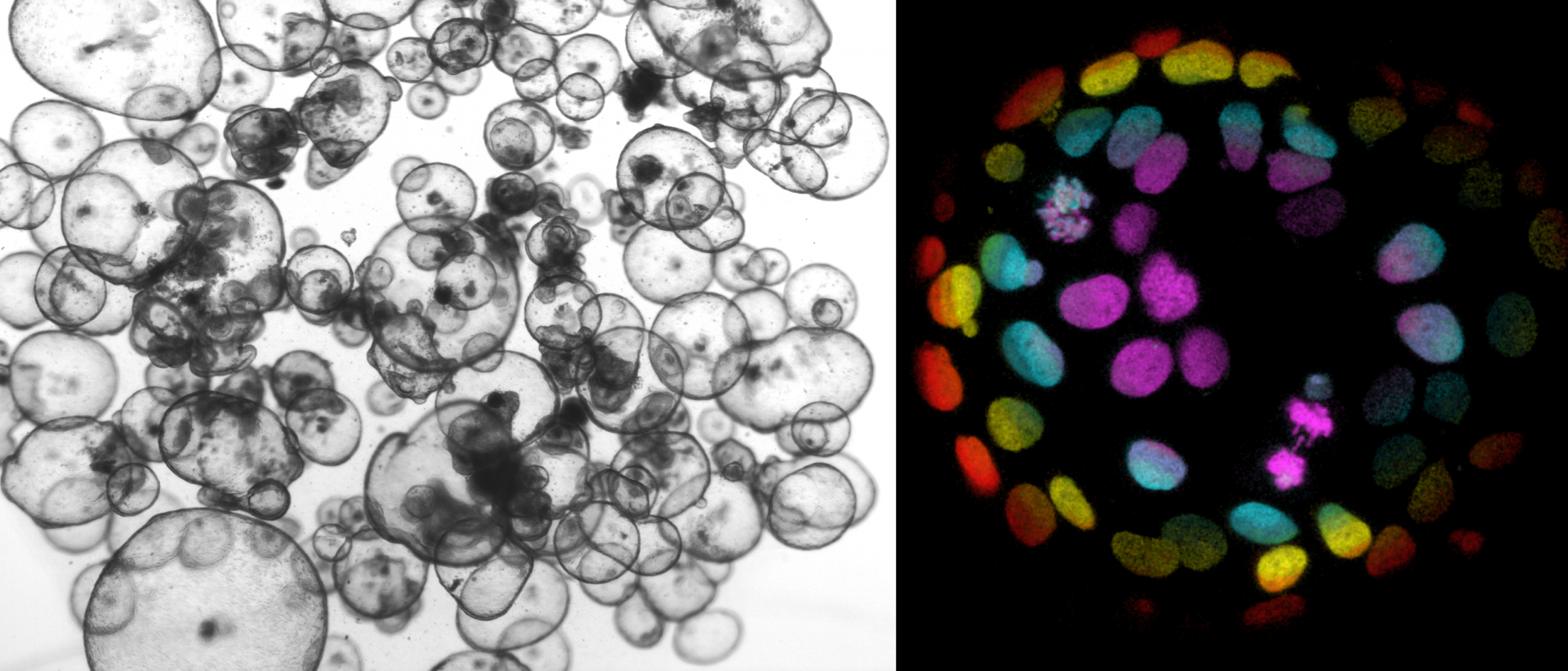
Licht microscopisch beeld van organoïden gekweekt uit gezond humaan darmweefsel (links). Kleurgecodeerde confocale beelden van een H2B-mNeon-gelabelde kankerorganoïde om chromosoom scheiding in beeld te brengen (rechts; Drost et al., Nature 2015).
Beurzen
- Karakterisering van de immune micro-omgeving van rhabdomyosarcoom voor de ontwikkeling van immuuntherapie - CoFund Butterfly (2023)
- Oncode-PACT: the Preclinical Accelerator for Cancer Treatments (National Growth Fund) – Oncode-PACT (2023) - News Article
- Oncode Technologie Ontwikkelfonds (2022)
- NWO-Vidi beurs (2021) - News Article
- KiKa Onderzoeksbeurs (2021)
- European Research Council (ERC) Startbeurs (2019) - News Article
- KiKa Pilotbeurs (2019)
- Geselecterrd als Oncode junior onderzoekgroepsleider (2019)
- KiKa Onderzoeksbeurs (2018)
- KiKa Onderzoeksbeurs (2017)
- NWO-Veni beurs (2014)
Twinning program KiTZ
- Ontcijfering van epigenetische herprogrammering in kwaadaardige rhabdoïde tumoren– with M. Kool and P. Johann (KiTZ) (2022 - 2023)
- Gevoeligheid voor MEK-remmer in Wilms-tumoren onthult potentieel nieuwe biomarker voor gerichte therapie – with N. Jäger (KiTZ) (2023 - 2024)
Princess Máxima Center Foundation
- Via de Princess Máxima Center Foundation worden regelmatig donaties ontvangen. Met dankbaarheid besteedt de Drost-groep deze donaties aan onderzoek met als doel nieuwe, minder toxische therapieën te ontwikkelen voor kinderen met kanker.
Awards
- AACR St. Baldrick’s career development award – Prijs voor opkomende leiders op het gebied van kinderoncologie (2020) - News Article
- Patrick Hanlo Award – Prijs voor beste postdoctorale onderzoeker van het Hubrecht Instituut (2017)
- Bas Mulder/Young Investigator Award from the Dutch Cancer Society (KWF) (2016)
Belangrijke publicaties
Drost J#, Clevers H. Organoids in cancer research. (2018) Nature Reviews Cancer Apr 24. Press here for the full text version of the article.
Fumagalli A, Suijkerbuijk SJE, Begthel H, Beerling E, Oost KC, Snippert HJ, van Rheenen J#, Drost J#. An orthotopic organoid transplantation approach in mice to visualize and study colorectal cancer progression. (2018) Nature Protocols 13: 235 – 247. Press here for the full text version of the article.
Drost J*, van Boxtel R*, Blokzijl F, Mizutani T, Sasaki N, Sasselli V, de Ligt J, Behjati S, Grolleman JE, van Wezel T, Nik-Zainal S, Kuiper RP, Cuppen E, Clevers H. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. (2017) Science 358: 234 – 238. Press here for the full text version of the article.
Fumagalli A*, Drost J*, Suijkerbuijk SJE, van Boxtel R, de Ligt J, Offerhaus GJ, Begthel H, Tan EH, Sansom OJ, Cuppen E, Clevers H, van Rheenen J. Genetic dissection of colorectal cancer progression by orthotopic transplantation of engineered cancer organoids. (2017) Proceedings of the National Academy of Sciences of the United States of America Mar 7. pii: 201701219. Press here for the full text version of the article.
Drost J, van Jaarsveld RH, Ponsioen B, Zimberlin C, van Boxtel R, Buijs A, Sachs N, Overmeer RM, Offerhaus GJ, Begthel H, Korving J, van de Wetering M, Schwank G, Logtenberg M, Cuppen E, Snippert HJ, Medema JP, Kops GJPL, Clevers H. Sequential cancer mutations in cultured human intestinal stem cells. (2015) Nature 521:43 – 47. Press here for the full text version of the article.
* Equal contribution
# Corresponding authors




















