Onderzoekgroepsleider: Weng Chuan Peng
Leverkanker bij kinderen
Jaarlijks krijgen ongeveer 8 tot 10 kinderen in Nederland de diagnose leverkanker, een aantal dat deels toeneemt door een toename van vroeggeboortes. Onder deze jonge patiënten zijn hepatoblastoom en hepatocellulair carcinoom de meest voorkomende tumortypen. Hepatoblastoom komt voor in verschillende histologische subtypen, waaronder het meer gedifferentieerde foetale subtype en het minder gedifferentieerde embryonale subtype. Daarentegen vertoont hepatocellulair carcinoom duidelijke pathologische en biologische verschillen in vergelijking met hepatoblastoom. Bij adolescenten en jongvolwassenen ontstaat hepatocellulair carcinoom vaak als gevolg van een onderliggende metabole leverziekte. Deze zeldzame erfelijke aandoeningen, die meestal worden veroorzaakt door een defect in één enkel gen, kunnen leiden tot ernstige leverfunctiestoornissen. Hoewel levertransplantatie vaak de enige curatieve optie is, brengt het aanzienlijke uitdagingen met zich mee, zoals een tekort aan donororganen en het risico op afstoting, wat de noodzaak van innovatieve behandelmethoden onderstreept. De zeldzaamheid van leverkanker bij kinderen en metabole leverziekten vormt een grote uitdaging voor onderzoek en benadrukt de dringende behoefte aan gespecialiseerde studies die zich richten op deze specifieke patiëntengroepen.

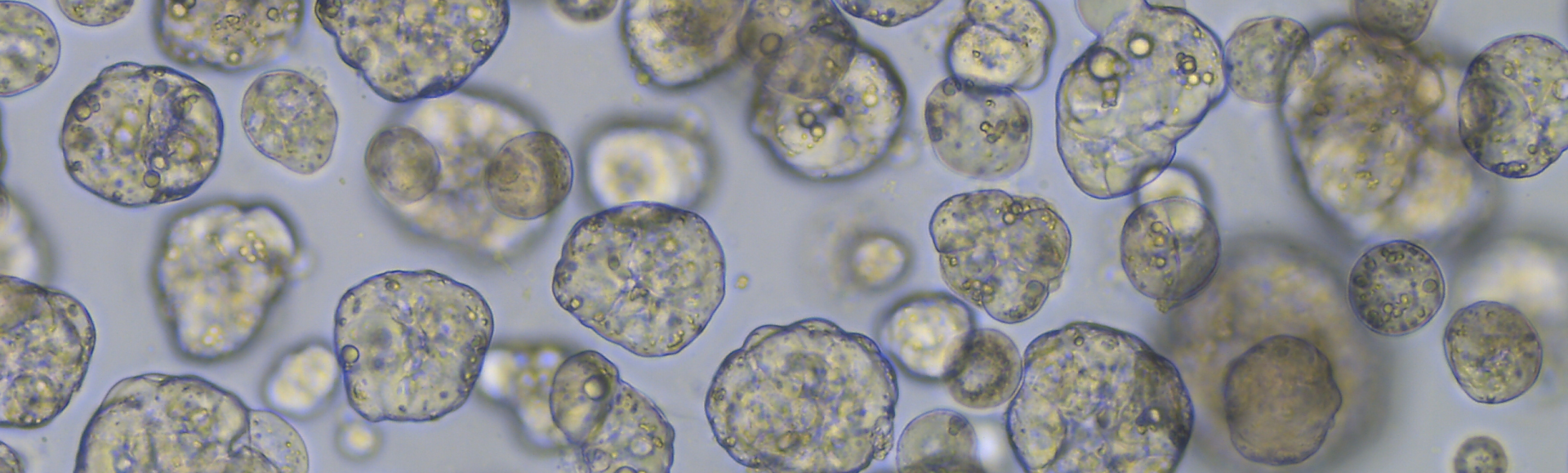
Levertumororganoïden
Gezien de zeldzaamheid van levertumoren bij kinderen, zijn de door de Peng-groep ontwikkelde patiënt-afgeleide tumororganoïden een onmisbare bron voor preklinisch onderzoek. Wij waren de eersten die een uitgebreid cohort van patiënt-afgeleide tumororganoïden uit verschillende stadia van hepatoblastoom hebben samengesteld. Deze in het laboratorium gekweekte tumorcellen worden gebruikt voor verschillende onderzoeken, zoals het modelleren van de werkzaamheid van gemodificeerde T-cellen, geneesmiddelenscreening, genbewerking en het testen van RNA-therapieën. Daarnaast hebben we bijgedragen aan de ontwikkeling van organoïdemodellen voor pediatrische levertumoren als onderdeel van het ITCC-P4-consortium en de Nederlandse Oncode Accelerator Foundation.
Primaire hepatocytorganoïden
Volwassen hepatocyten, waaronder diploïde en polyploïde cellen, kunnen worden gestimuleerd om te prolifereren zonder dat stamcellen nodig zijn. In 2018 waren we de eersten die aantoonden dat muizenhepatocyten, het belangrijkste celtype in de lever, onbeperkt kunnen worden gekweekt in 3D-organoïdeculturen door gebruik te maken van factoren die betrokken zijn bij weefselherstel. Een belangrijke doorbraak is dat hepatocytorganoïden efficiënt kunnen inplanten in beschadigde muizenlevers en de leverfunctie kunnen herstellen. Het vermogen om grote aantallen gezonde hepatocyten te genereren is de eerste cruciale stap richting celvervangingstherapie voor patiënten met leverziekten, wat mogelijk een oplossing biedt voor het wereldwijde tekort aan donororganen. Daarnaast ontwikkelen we actief geavanceerdere organoïdemodellen.
Single-cell-analyse, spatial transcriptomics en high-plex imaging
We zetten ons in om de complexiteit van leverziekten te ontrafelen met behulp van geavanceerde technologieën. Tot onze belangrijkste doelen behoren het begrijpen van de moleculaire heterogeniteit van verschillende pediatrische tumorsubtypen, het identificeren van kritieke signaalpaden en het onderzoeken van de immuunmicro-omgeving van tumoren. Om deze doelen te bereiken, gebruiken we multi-omics-benaderingen, waaronder single-cell-analyse van het transcriptoom en epigenoom, spatial transcriptomics, high-plex imaging en labelvrije massaspectrometrie-gebaseerde proteomics.
Ontwikkeling van therapieën
Met de kennis die we hebben opgedaan met onze tumormodellen, streven we ernaar om nieuwe therapieën te ontwikkelen. We hopen tumorspecifieke behandelingsstrategieën te vinden om kinderen met leverkanker gerichter te behandelen, waardoor minder patiënten worden blootgesteld aan hoge doses chemotherapie en uiteindelijk meer kinderen genezen zonder hun kwaliteit van leven in gevaar te brengen. Mogelijke nieuwe behandelingsopties voor deze patiënten zijn onder meer immunotherapieën, antilichaamtherapieën en kleine moleculaire remmers. Voor patiënten met metabole leverziekten richten we ons op genbewerking, RNA-therapieën en celvervangingstherapieën als mogelijke behandelingsstrategieën.
Kluiver TA#, Lu Y#, Schubert SA, Kraaier LJ, Ringnalda F, Lijnzaad P, DeMartino J, Megchelenbrink WL, Amo-Addae V, Eising S, de Faria FW, Münter DJ, van de Wetering M, Kerl K, Duiker E, van den Heuvel M, de Meijer VE, de Kleine RH, de Krijger RR, Molenaar JJ, Margaritis T, Stunnenberg H, Zsiros J, Clevers H, Peng WC*. Divergent WNT Signaling and Drug Sensitivity Profiles within Hepatoblastoma Tumors and Organoids. Nat Commun.2024; 15, 8576. Read here.
Krijgsman D#, Kraaier LJ#, Verdonschot M, Schubert SA, Duiker E, de Kleine R, de Meijer V, de Krijger RR, Zsiros J, Leusen J, Peng WC*, Vercoulen Y*. Hepatoblastoma exhibits a predominantly myeloid immune landscape and reveals opportunities for macrophage targeted immunotherapy. 2023. BioRxiv. Read here.
Kluiver TA, Kraaier LJ, Peng WC*. Long-Term Expansion of Murine Primary Hepatocyte Organoids. Methods Mol Biol. 2022;2544:1-13. Read here.
Peng WC*, Kraaier LJ, Kluiver TA. Hepatocyte organoids and cell transplantation: What the future holds. Exp Mol Med. 2021;53(10):1512-1528. Read here.
Tabula Muris Consortium. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature. 2020 Jul;583(7817):590-595. Read here.
Peng WC*, Logan CY, Fish M, Anbarchian T, Aguisanda F, Alvarez A, Wu P, Jin Y, Zhu J, Li B, Grompe M, Wang B, Nusse R*. Inflammatory cytokine TNFa promotes the long-term expansion of primary hepatocytes in 3D culture. Cell. 2018. 175, 607–1619.e1615. (*corresponding authors, F1000 recommendations) Read here.
Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 2018 Oct;562(7727):367-372. Read here.
- Integrated multiomic and drug profiling of pediatric liver tumor organoids to investigate tumor biology and to identify novel therapeutic strategies - KiKa Research Grant (2024-2026). News Article
- Oncode Accelerator Foundation, Dutch National Growth Fund (2024-2026).
- KWF Research Project (2024-2027), with Dr. Dennis Beringer, Prof. Jūrgen Kuball. News Article
- STOmics Grant Program, Spatial Temporal Omics Consortium (2023-2024). Consortium website
- ITCC-P4 Organoid Mirror Project (2023-2024), with Molenaar group.
- Strategic Program Cancer Grant, UMC Utrecht (2022-2023), with Dr. Yvonne Vercoulen, Dr. Daniëlle Krijgsman.
- Twinning program KiTZ . Toward precision medicines for liver tumors – with dr. Zsiros, dr. Ina Oehme(KiTZ) (2022-2023)
- Donations are regularly received through the Princess Máxima Center Foundation. With gratitude, the Peng group spends these donations on the generation and characterization of patient-derived tumor organoid models. An important donor is ‘Kus van Kiki’.








