Onderzoekgroepsleider: Dr. Ruben van Boxtel
Thema 1: Het ontstaan van kinderkanker
Waarom krijgen kinderen kanker? Voor sommige kankersoorten, zoals leukemie, is er een hogere incidentie in jonge kinderen vergeleken met jongvolwassenen. Dit is vreemd, omdat kankers gedreven worden door DNA-veranderingen en jonge cellen hebben een kleiner aantal van dit soort veranderingen vergeleken met oudere cellen. Echter, de factoren die belangrijk zijn in het veroorzaken van leukemie zijn nog onbekend. Door DNA-veranderingen systematisch in kaart te brengen in bloedstamcellen voordat deze transformeren in een leukemie, willen we de moleculaire en cellulaire mechanismen in kaart brengen die belangrijk zijn voor het ontstaan van de ziekte. Om dit te bereiken, combineren we celkweeksystemen, DNA-sequensen en bio-informatica, zodat we de processen in kaart kunnen brengen die verantwoordelijk voor het veroorzaken van kanker drijvende DNA-veranderingen. Vervolgens onderzoeken we hoe cellen met deze specifieke DNA-veranderingen uiteindelijk kunnen uitgroeien tot een kanker. Ook maken we gebruik van celkweek systemen in combinatie met het gericht aanbrengen van genetische veranderingen om onze bevindingen direct in relevante cellen te valideren. Dit werk zal bijdrage aan het identificeren van risicofactoren voor kinderkanker en een verbeterde interpretatie DNA-data voor diagnostische doeleinden.
Thema 2: De consequenties van behandeling op stamcellen
Wat veroorzaakt tweede kankers bij mensen die een eerdere kinderkanker overleefd hebben? Mensen die kinderkanker overleven, hebben als gevolg van hun levensreddende therapie een verhoogde kans op het ontwikkelen van een tweede kanker. Om langdurige overleving en kwaliteit van leven te waarborgen is het belangrijk om patiëntgebonden risicofactoren te identificeren en preventieve maatregelen te ontwikkelen. Hiervoor is een beter begrip nodig wat betreft het ontstaan van tweede therapie-gerelateerde kankers. Om dit te bereiken, zullen wij de moleculaire en cellulaire mechanismen identificeren en bestuderen, die belangrijk zijn voor de initiatie van tweede kankers. Dit doen we door DNA-veranderingen te bestuderen in stamcellen van patiënten, die een tweede therapie-gerelateerde kanker hebben ontwikkeld. Door normale stamcellen van deze patiënten te vergelijken met kankercellen willen we de processen identificeren die kanker drijvende DNA-veranderingen veroorzaken en bestuderen hoe deze ervoor zorgen dat de kankercellen kunnen uitgroeien. Met deze studies zullen we patiëntgebonden risicofactoren identificeren en uiteindelijk bijdragen aan nieuwe preventieve therapieën.

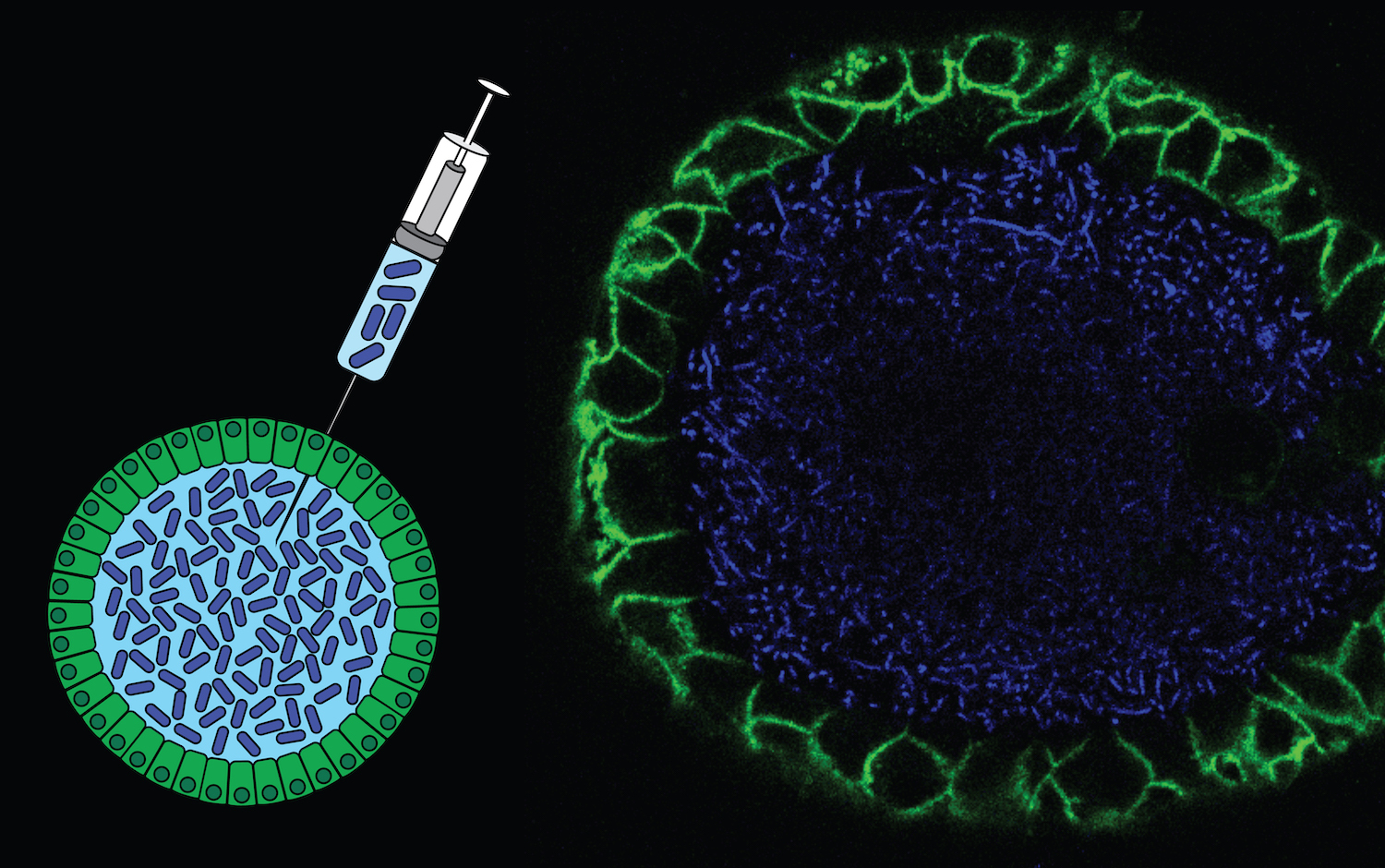
Bloedstamcellen uit de navelstreng zijn gesorteerd aan de hand van geselecteerde deeltjes (FACS-sorting). Kankercellen (CD34+Lin-) zijn per cel gesorteerd in een plaat met 384 wellen. De rode punten weerspiegelen de gesorteerde cellen. Ongeveer 25% van deze cellen zijn van het type CD34+Lin-CD38-CD45RA-.
Methode: DNA als een historisch archief boordevol informatie over het leven van een cel
Kanker is een resultaat van evolutionaire processen, die actief zijn in normale weefsels. Veranderingen in het DNA vinden stochastisch plaats en zorgen voor variatie tussen cellen. Vervolgens zijn er evolutionaire krachten actief, zoals selectie en drift, die de clonale compositie van cel populaties vormen. Sommige DNA-veranderingen geven cellen de eigenschap om onafhankelijk te worden van externe groeistimuli, of juist ongevoelig voor intrinsieke remmingen, waardoor ze ongecontroleerd kunnen gaan delen. Afhankelijk van welke evolutionaire krachten op dat moment actief zijn, kan deze genetische diversiteit bijdragen aan de initiatie van kanker. DNA is het grootste biomolecuul in cellen dat, in tegenstelling tot andere moleculen, niet vervangbaar is. Hierdoor zullen DNA-veranderingen, die het resultaat zijn van verkeerd of niet-gerepareerde DNA-schade, gedurende het leven van een cel ophopen. De complete collectie van DNA-veranderingen in een cel op een bepaald moment kan daarom gezien worden als een historisch archief, dat afdrukken bevat van mutagene processen, selectieve druk en informatie over de genetische relatie tussen verschillende cellen in een populatie. Het is onze missie om dit archief te ontcijferen en zo te achterhalen wat de moleculaire en cellulaire mechanismen zijn die bijdragen aan de ontwikkeling van kanker.
De witte bloedcellen (AHH-1) worden gekweekt in het laboratorium. Het zijn menselijke cellen die in kweek heel stabiel zijn. We gebruiken ze onder andere voor genetische studies.
- 2024-2029 Vici - Nieuwsbericht
- 2023 – 2028 NYSCF Robertson Stem Cell Investigator Award - Nieuwsbericht
- 2023 – 2028 Ammodo Science Award for groundbreaking research (Omnes Pro Uno) - Nieuwsbericht
- 2023 – 2026 Landsteiner Foundation for Blood Transfusion Research (LSBR) Research Grant
- 2022 – 2026 KiKa Research Project
- 2020 – 2023 KWF Cancer Research Project Grant
- 2020 – 2025 ERC Consolidator award (SecondCANCERinKIDS)
- 2019 – 2023 Selected Oncode Investigator after a highly competitive open recruitment call
- 2019 – 2023 KWF Cancer Research Project Grant
- 2018 – 2021 KWF Cancer Research Project Grant
- 2017 – 2022 NWO Vidi award
Rosendahl Huber A*, Pleguezuelos-Manzano C*, Puschhof J*, Ubels J*, Boot C, Saftien A, Verheul M, Trabut LT, Groenen N, van Roosmalen M, Ouyang KS, Wood H, Quirke P, Meijer G, Cuppen E, Clevers H#, van Boxtel R#. Improved detection of colibactin-induced mutations by genotoxic E. coli in organoids and colorectal cancer. (2024) Cancer Cell
Middelkamp S, Manders F, Peci F, van Roosmalen MJ, González DM, Bertrums EJM, van der Werf I, Derks LLM, Groenen NM, Verheul M, Trabut L, Pleguezuelos-Manzano C, Brandsma AM, Antoniou E, Reinhardt D, Bierings M, Belderbos ME, van Boxtel R. Comprehensive single-cell genome analysis at nucleotide resolution using the PTA Analysis Toolbox. (2023) Cell Genom. 3:100389.
Bertrums EJM, Rosendahl Huber AKM, de Kanter JK, Brandsma AM, van Leeuwen AJCN, Verheul M, van den Heuvel-Eibrink MM, Oka R, van Roosmalen MJ, de Groot-Kruseman HA, Zwaan CM, Goemans BF, van Boxtel R. Elevated Mutational Age in Blood of Children Treated for Cancer Contributes to Therapy-Related Myeloid Neoplasms. (2022) Cancer Discovery 12:1860-1872.
de Kanter J, Peci F, Bertrums E, Rosendahl Huber A, van Leeuwen A, van Roosmalen MJ, Manders F, Verheul M, Oka R, Brandsma AM, Bierings M, Belderbos M#, van Boxtel R#. Antiviral treatment causes a unique mutational signature in cancers of transplantation recipients. (2021) Cell Stem Cell 28:1726-1739.e6.
Pleguezuelos-Manzano C*, Puschhof J*, Rosendahl Huber A*, van Hoeck A, Wood HM, Nomburg J, Gurjao C, Manders F, Dalmasso G, Stege PB, Paganelli FL, Geurts MH, Beumer J, Mizutani T, Miao Y, van der Linden R, van der Elst S; Genomics England Research Consortium, Garcia KC, Top J, Willems RJL, Giannakis M, Bonnet R, Quirke P, Meyerson M, Cuppen E, van Boxtel R#, Clevers H#. Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. (2020) Nature580:269-273
Jager M, Blokzijl F, Sasselli V, Boymans S, Janssen R, Besselink N, Clevers H, van Boxtel R*, Cuppen E*. Measuring mutation accumulation in single human adult stem cells by whole-genome sequencing of organoid cultures. (2018) Nature Protocols 13:59–78. PubMed PMID: 29215633
Drost J*, van Boxtel R*, Blokzijl F, Mizutani T, Sasaki N, Sasselli V, de Ligt J, Behjati S, Grolleman JE, van Wezel T, Nik-Zainal S, Kuiper RP, Cuppen E, Clevers H. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. (2017) Science 358:234-238. PubMed PMID: 28912133
Blokzijl F, de Ligt J, Jager M, Sasselli V, Roerink S, Sasaki N, Huch M, Boymans S, Kuijk E, Prins P, Nijman IJ, Martincorena I, Mokry M, Wiegerinck CL, Middendorp S, Sato T, Schwank G, Nieuwenhuis EE, Verstegen MM, van der Laan LJ, de Jonge J, IJzermans JN, Vries RG, van de Wetering M, Stratton MR, Clevers H, Cuppen E, van Boxtel R. Tissue-specific mutation accumulation in human adult stem cells during life. (2016) Nature 538:260-264. PubMed PMID: 27698416
Huch M*, Gehart H*, van Boxtel R*, Hamer K, Blokzijl F, Verstegen MM, Ellis E, van Wenum M, Fuchs SA, de Ligt J, van de Wetering M, Sasaki N, Boers SJ, Kemperman H, de Jonge J, Ijzermans JN, Nieuwenhuis EE, Hoekstra R, Strom S, Vries RR, van der Laan LJ, Cuppen E, Clevers H. Long-term culture of genome-stable bipotent stem cells from adult human liver. (2015) Cell 160:299-312. PubMed PMID: 25533785
van Boxtel R, Gomez-Puerto C, Mokry M, Eijkelenboom A, van der Vos KE, Nieuwenhuis EE, Burgering BM, Lam EW, Coffer PJ. FOXP1 acts through a negative feedback loop to suppress FOXO-induced apoptosis. (2013) Cell Death & Differentiation 20:1219-1229. PubMed PMID: 23832113
*Equal contribution





















