Onderzoekgroepsleider: Prof. dr. Jan Molenaar
Doelgerichte medicijnontwikkeling
Lead: Marlinde van den Boogaard
Op dit moment is een zeer efficiënte pijplijn voor het volledige spectrum van de ontwikkeling van doelgerichte geneesmiddelen in gebruik. Het proces begint bij de validatie van doelwitgenen met behulp van high-throughput analyses zoals Affymetrix mRNA-profiling, RNAseq, Whole Genome Sequencing en single-cell analyse. We werken nu aan een dataset van meer dan 500 neuroblastoomtumoren waarvoor WGS- en RNA-profiling data beschikbaar zijn. Met integratieve analyses op deze tumorsamples kunnen nieuwe driver events worden geïdentificeerd, en kunnen genomische veranderingen worden gerelateerd aan klinische subgroepen binnen neuroblastoom. Potentiële nieuwe doelwitgenen worden vervolgens gevalideerd in cellijnen middels verschillende moleculair genetische manipulatietechnieken. De meest belovende doelwitgenen worden in vitro en in vivo verder gevalideerd met behulp van small molecule inhibitors. Er zijn verschillende nieuwe modellen ontwikkeld om dit proces te versterken: we gebruiken tumororganoïden en implementeren nieuwe in vivo xenograft- en transgene modellen. De huidige onderzoeken bevinden zich in verschillende stadia en zijn gericht op MDM2, CDK4/6, CDKN2A, de MEK-pathway, BCL2 / MCL1, CHK1, ATRX en MTH1 bij neuroblastoom met het CtoA-mutator fenotype.
Immunotherapie
Lead: Judith Wienke
Het doel van dit project is het identificeren van nieuwe doelwitgenen voor immuuntherapie bij neuroblastoom en het onderzoeken en ontwikkelen van nieuwe innovatieve (combinaties van) immunotherapeutische interventies voor klinische toepassing. We bestuderen de immuunomgeving van neuroblastoom en mogelijk andere tumoren, te beginnen met single cell RNA-sequencing en isolatie van tumor-infiltrerende immuuncellen om nieuwe doelwitgenen voor immuuntherapie te identificeren. Het identificeren van doelwitgenen zal gericht zijn op zowel het ondermijnen van immuunontwijking door tumoren als het verhogen van de antitumoreffectiviteit van immuuncellen. Na validatie van doelwitgenen zullen verschillende strategieën en combinaties van immunotherapeutische interventies worden getest; eerst in vitro op tumorcellijnen en tumororganoïden, en later in vivo in muismodellen. Uiteindelijk zullen effectieve interventies worden geïntroduceerd in de klinische testfase.
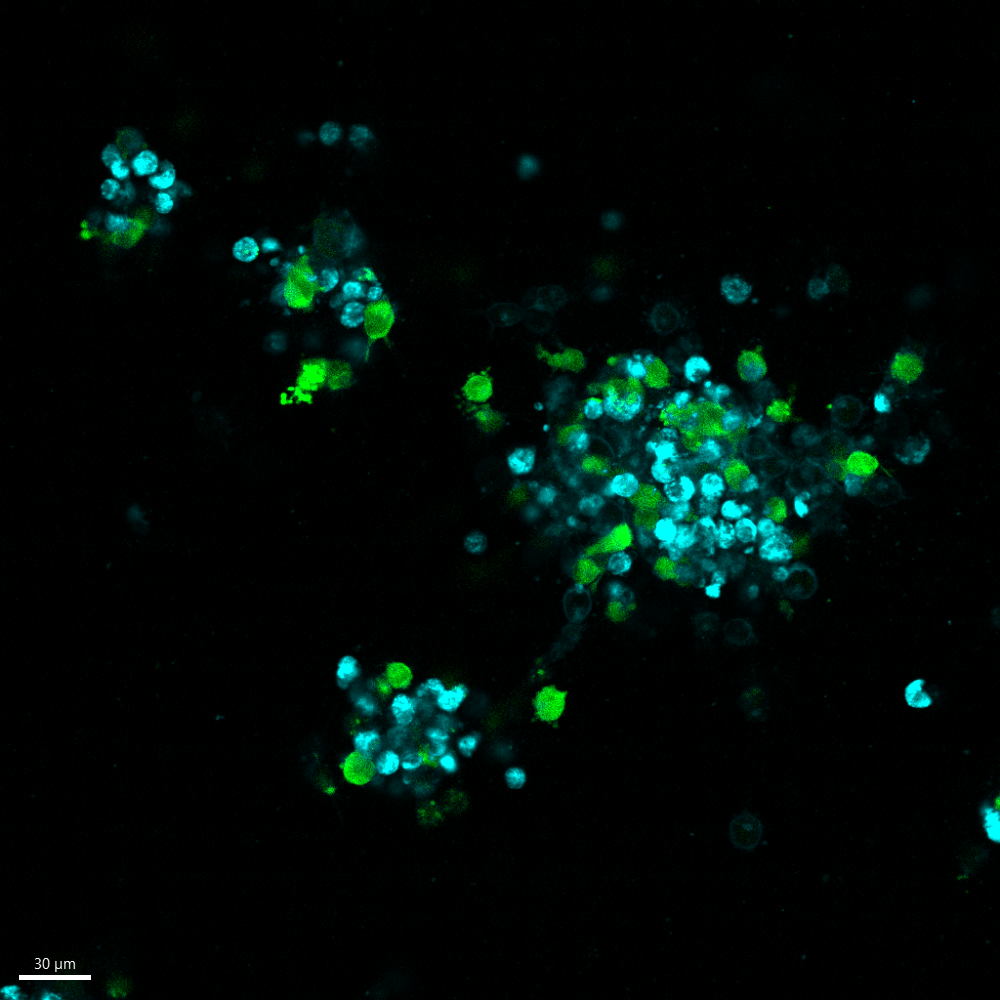
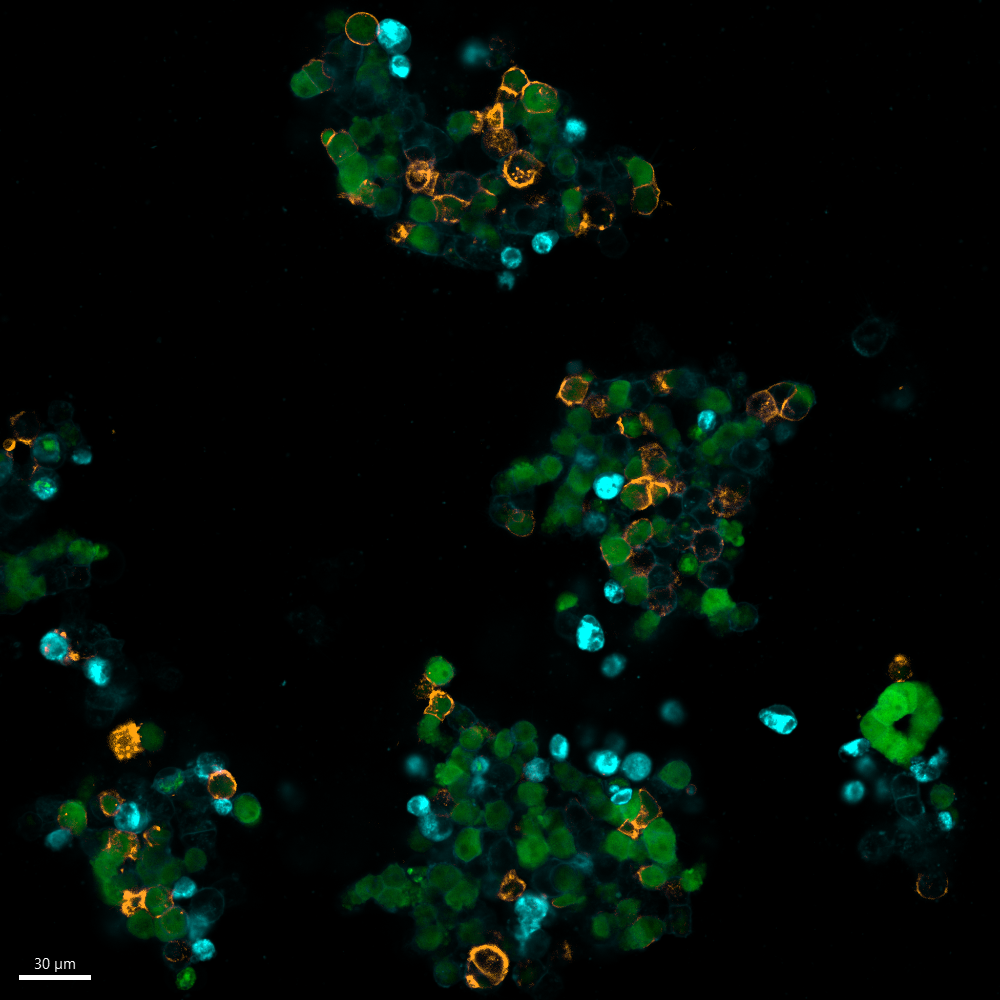
In deze figuur tonen we de binding van dinutuximab (anti-GD2) aan twee van onze met Luc-GFP getransfecteerde organoïdemodellen: 691T (links) en 691B (rechts). De 691T organoïden, afkomstig van de tumor, missen GD2 expressie, terwijl de 691B organoïden, afkomstig van het beenmerg van 691T, GD2 tot expressie brengt op het celoppervlak. Het GFP-construct is weergegeven in groen en CellBrite®, een cytoplasmatische membraanmarker, is weergegeven in blauw. Het fluorescent gelabelde Dinutuximab, afgebeeld in oranje, bindt aan het 691B organoid (rechts), omdat dit GD2 tot expressie brengt op het celoppervlak. Aangezien de 691T organoid (links) geen GD2 tot expressie brengt, kan Dinutuximab niet aan deze cellen binden.
Precisiegeneeskunde programma iTHER
Lead: Karin Langenberg
Het doel van het iTHER (individualized THERapy) programma is om een gepersonaliseerde behandeling te realiseren voor kinderen met recidiverende of refractaire, ongeneeslijke kanker. Het gaat om 150 patiënten per jaar. Het programma is een METC-goedgekeurde klinische registratiestudie die wordt uitgevoerd in samenwerking met de groepen van Michel Zwaan, Patrick Kemmeren en het diagnostisch lab van Bas Tops. Moleculaire karakterisering omvat Exome Sequencing, RNAseq en analyse van methylatiepatronen met behulp van de Máxima diagnostische-pijplijn. Gegevens worden opgeslagen in de kernfaciliteit van het Máxima en geanalyseerd met behulp van het R2 bio-informaticaplatform. We hebben een NWO-subsidie voor precisiegeneeskunde verkregen om het iTHER-programma verder te ontwikkelen, wat inhoudt: klinische implementatie van dit programma in het Máxima, koppelen van het programma aan doelgerichte therapieën, en uitbreiding van onze profilering met in vitro compound testen op tumororganoïden van patiëntenweefsel.
Compound screening en chemie
Lead: Selma Eising
Het doel van dit project is om nieuwe behandelingsopties bij kinderkanker te identificeren en te valideren met behulp van de high-throughput screeningfaciliteit.
De twee belangrijkste doelstellingen zijn: 1) De coördinatie van de compound screening faciliteit die in 2019 beschikbaar is gekomen. Het bevat een state-of-the-art BeckmanCoulter robotica-opstelling inclusief een Echo550 compound dispensersysteem. De faciliteit runt veel screens voor verschillende onderzoeksgroepen in het Máxima. 2) De integratie van in vitro modelsystemen om mogelijke interventies te valideren, nieuwe interventies te identificeren en mogelijke combinatiebehandelingsopties te identificeren voor patiënten zonder curatieve opties, als onderdeel van het iTHER-programma voor precisiegeneeskunde.
Bovendien wordt een nieuwe onderzoekslijn opgezet met als doel een nieuwe klasse geneesmiddelen genaamd PROteolysis Targeting Chimerase (PROTACs) in te zetten voor de behandeling van neuroblastoom. In de Molenaar groep hebben we veelvuldig chromosomale veranderingen en genomische afwijkingen geïdentificeerd die neuroblastoom aansturen. Twee van deze specifieke oncogene factoren worden gedefinieerd als ‘niet-doelgericht’, omdat ze niet kunnen worden getroffen met behulp van bestaande medicijnen. In samenwerking met het Utrechts Instituut voor Farmaceutische Wetenschappen streven we ernaar om deze doelwitgenen selectief af te breken met PROTACs.
- Het werkend maken van CDK inhibitoren voor kinderkanker - KWF (2024-2028)
- Verstoppertje: Het aanpakken van de ontsnapping van neuroblastoom aan het immuunssysteem - Horizon Europe MSCA Cofund Máxima Butterfly en Villa Joep (2023-2027) - Nieuwsbericht
- Afwijkende ATRX mutaties aanpakken om nieuwe behandelingsopties voor neeuroblastoom te identificeren - Horizon Europe MSCA Cofund Máxima Butterfly (2023-2027) - Nieuwsbericht
- Behandelbare afweerremmende mechanismen in kinderkanker– Roche (2023-2025)
- Krachten bundelen om T-cel immuniteit te activeren tegen hoog-risico neuroblastoom (met Nierkens groep en Van Heesch groep) - Villa Joep (2021 - 2025) - Nieuwsbericht
- VAGABOND Validatie van actionable genomische afwijkingen uitgevoerd door een netwerk van PhD studenten binnen de kinderoncologie (met Drost groep en den Boer groep) – H2020 MSCA ITN (2020-2024) - Nieuwsbericht
- Laat het beest los: Activeer CAR‐T cel immuuntherapie voor neuroblastoom – Veni (2022-2025) - Nieuwsbericht
- Optimalisatie van de klinische implementatie van BCL-2 remmers voor de behandeling van neuroblastoom patienten - Villa Joep (2023)
- Gepersonaliseerde behandeling voor kinderen (iPC): Cloud-gebaseerd virtuele patienten modellen voor precisie oncologie – H2020 SC1-DTH (2019-2023)
- Clinical implementation of Multidimensional Phenotypical drug sensitivities in pediatric precision oncology (COMPASS) – EraPerMed (2019-2023)
- Informing treatment decisions of relapsed neuroblastomas by inference of tumor evolution (INFER-NB) - EraCoSysMed (2020-2023)
- Klinische implementatie van een behandeling op maat (precision medicine program) (iTHER)- ZonMW (2018-2023) - Nieuwsbericht
- ITCC Pediatric Preclinical POC Platform (ITCC-P4) (met Kool groep, Heidenreich en andere groepen Máxima) – IMI2 H2020 (2018-2023)
- Geneesmiddelencombinaties testen in neuroblastoom organoïden voor het begeleiden van klinische studies (PREDICT) – ERC Starting Grant (2017-2022)
- Combineren van targeted compounds voor neuroblastoom; twee beter dan één? - VIDI ZonMW (2015-2020)
Twinning program KiTZ
Ontwikkeling en implementatie van een gepersonaliseerde geneesmiddel sensitiviteit profiling pijplijn als stratificatie methode voor kinderen met solide of CNS tumoren (2022-2023) - Nieuwsbericht
Integrative analysis of neuroblastoma by single-cell RNA sequencing identifies the NECTIN2-TIGIT axis as a target for immunotherapy. J Wienke,L Visser, W Kholosy, K Keller,M Barisa,E Poon,S Munnings-Tomes,C Himsworth, E Calton, A Rodriguez, R Bernardi,F van den Ham, S van Hooff, Y Matser, M Tas, K Langenberg, P Lijnzaad, A Borst, E Zappa, F Bergsma, J Strijker, B Verhoeven, S Mei, A Kramdi, R Restuadi, A Sanchez-Bernabeu, A Cornel, F Holstege, J Gray, G Tytgat, M Scheijde-Vermeulen, M Wijnen, M Dierselhuis, K Straathof, S Behjati, W Wu, A Heck, J Koster, S Nierkens, I Janoueix-Lerosey, R de Krijger, N Baryawno, L Chesler, J Anderson, H Caron, T Margaritis, M van Noesel and J Molenaar, Cancer Cell 42, 283–300, doi:10.1016/j.ccell.2023.12.008 Pubmed PMID: 38181797
Implementation of paediatric precision oncology into clinical practice: The Individualized Therapies for Children with cancer program 'iTHER'. K Langenberg, M Meister, J Bakhuizen, J Boer, N van Eijkelenburg, E Hulleman, U Ilan, E Looze, M Dierselhuis, J van der Lugt, W Breunis, L Schild, K Ober, S van Hooff, M Scheijde-Vermeulen, L Hiemcke-Jiwa, U Flucke, M Kranendonk, P Wesseling, E Sonneveld, S Punt, A Boltjes, F van Dijk, E Verwiel, R Volckmann, J Hehir-Kwa, L Kester, M Koudijs, E Waanders, F Holstege, J Vormoor, E Hoving, M van Noesel, R Pieters, M Kool, M Stumpf, M Blattner-Johnson, G Balasubramanian, C Van Tilburg, B Jones, D Jones, O Witt, S Pfister, M Jongmans, R Kuiper, R de Krijger, M Wijnen, M den Boer, M Zwaan, P Kemmeren, J Koster, B Tops, B Goemans, J Molenaar. Eur J Cancer. 2022 Nov:175:311-325. doi: 10.1016/j.ejca.2022.09.001 Pubmed ID 36182817
Tumor to normal single-cell mRNA comparisons reveal a pan-neuroblastoma cancer cell. Kildisiute G, Kholosy WM, Young MD, Roberts K, Elmentaite R, van Hooff SR, Pacyna CN, Khabirova E, Piapi A, Thevanesan C, Bugallo-Blanco E, Burke C, Mamanova L, Keller KM, Langenberg-Ververgaert KPS, Lijnzaad P, Margaritis T, Holstege FCP, Tas ML, Wijnen MHWA, van Noesel MM, Del Valle I, Barone G, van der Linden R, Duncan C, Anderson J, Achermann JC, Haniffa M, Teichmann SA, Rampling D, Sebire NJ, He X, de Krijger RR, Barker RA, Meyer KB, Bayraktar O, Straathof K, Molenaar JJ (corresponding author), Behjati S. Science Advances. 2021 Feb 5;7(6):eabd3311. doi: 10.1126/sciadv.abd3311. Pubmed PMID: 33547074
Relapsed neuroblastomas show frequent RAS-MAPK pathway mutations. Eleveld TF, Oldridge DA, V Bernard, J Koster, LC Daage, SJ Diskin, L Schild, N Bentahar, A Bellini, M Chicard, E Lapouble, V Combaret, P Legoix-Né, J Michon, TJ Pugh, LS Hart, JA Rader, EF Attiyeh, JS Wei, S Zhang, A Naranjo, JM Gastier-Foster, MD Hogarty, MA. Smith, JM Guidry Auvil. TBK Watkins, DA Zwijnenburg, ME Ebus, P v Sluis, A Hakkert, E v Wezel, CE vd Schoot, EM Westerhout, JH Schulte, GA Tytgat, MEM Dolman, , I Janoueix-Lerosey, DS Gerhard, HN Caron, O Delattre, J Khan, R Versteeg, G Schleiermacher, Molenaar JJ (corr. author), Maris JM. Nature Genetics. 2015 Pubmed PMID: 26121087
Sequencing of neuroblastoma identifies chromothripsis and defects in neuritogenesis genes. Molenaar JJ, Koster J, Zwijnenburg DA, van Sluis P, Valentijn LJ, van der Ploeg I, Hamdi M, van Nes J, Westerman BA, van Arkel J, Ebus ME, Haneveld F, Lakeman A, Schild L, Molenaar P, Stroeken P, van Noesel MM, Ora I, Santo EE, Caron HN, Westerhout EM, Versteeg R. Nature. 2012 Feb 22;483(7391):589-93. Pubmed PMID: 22367537


























