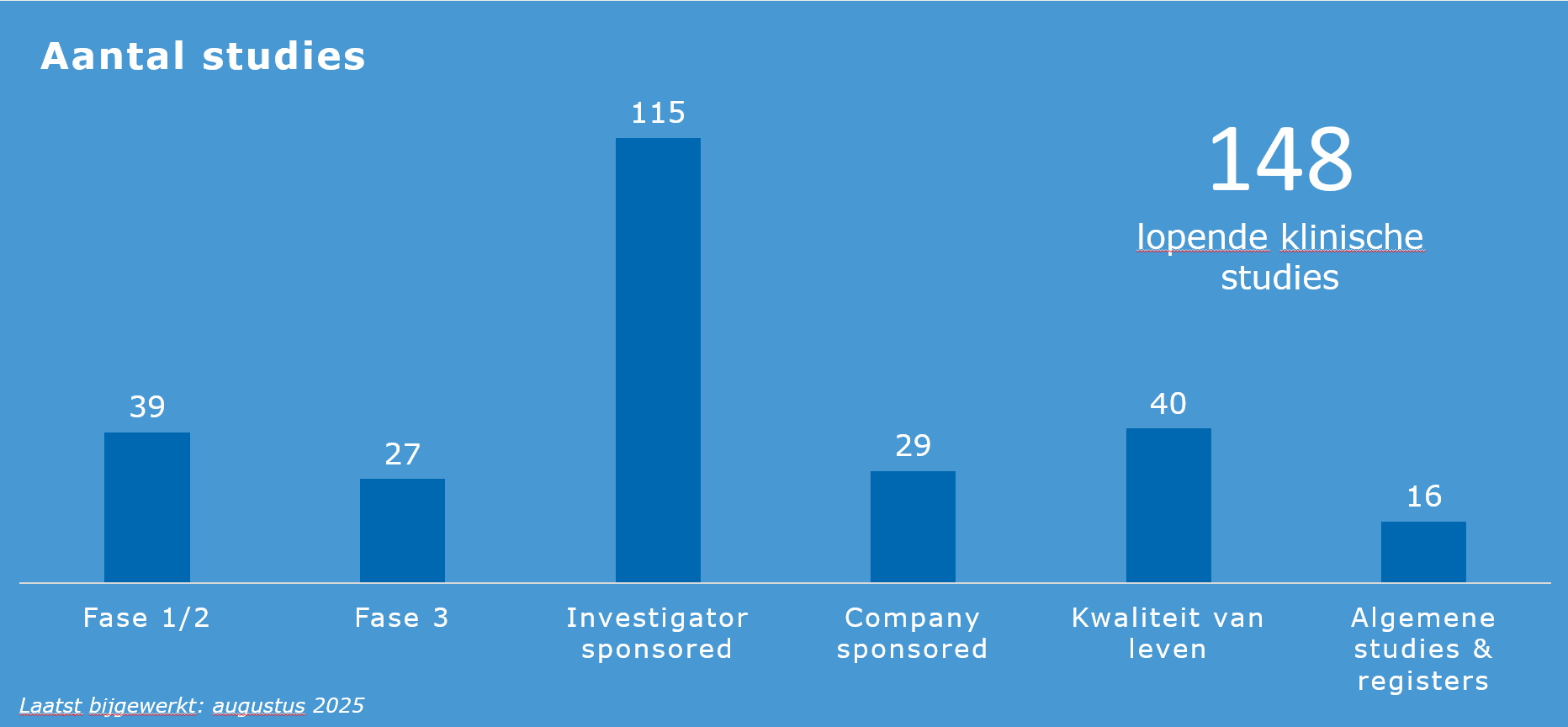
In het Prinses Máxima Centrum lopen meer dan 100 klinische studies en dat aantal neemt steeds verder toe. Als nationaal centrum voor kinderoncologie coördineert het Máxima alle Nederlandse studies op het gebied van kinderoncologie. Daaronder ook registratiestudies voor nieuwe geneesmiddelen die voor de kinderoncologie van belang zijn, zoals brigatinib en venetoclax.
Daarnaast fungeert het Máxima steeds vaker als verrichter (opdrachtgever) van internationale studies, bijvoorbeeld Interfant-21 en CHIP-AML. Door de toegang tot patiënten en internationale samenwerkingen (met onder andere ITCC, PedAL, NANT, SIOPe en PNOC consortia) heeft het Máxima een sterke internationale positie. Binnen de Europese Unie is er geen vergelijkbare verrichter voor studies bij kinderen met kanker.
Het TDC is binnen het Máxima de centrale kernfaciliteit (one-stop shop) voor alle klinische studies en dataverzoeken.
Het TDC verzorgt de implementatie en uitvoering van alle klinische studies waarvoor patiënten worden gerekruteerd in het Máxima. Dit omvat zowel studies geïnitieerd door onderzoekers in academische centra als studies opgezet door farmaceutische bedrijven. Daarnaast verzorgt het TDC de opzet en coördinatie van door onderzoekers geïnitieerde studies die zowel nationaal als internationaal uitgevoerd worden.
Het gaat daarbij onder meer om:
Het TDC biedt daarbij:
Het TDC is verantwoordelijk voor de verwerking, uitlevering en duiding van klinische data ten behoeve van onderzoek en kwaliteit. Het TDC biedt advies en ondersteuning bij het gebruik van klinische data en daaraan gekoppelde processen en organisatie. Dat betreft onder andere de opzet en uitvoering van studies, registraties en protocollen, research data governance, kwaliteit en integriteit van data en innovatieve toekomstige (onderzoeks-)datavoorzieningen. Verder biedt het TDC onder andere expertise op het gebied van:
Met meer dan 100 gemotiveerde en enthousiaste medewerkers beschikt het TDC over brede expertise waarmee we streven naar het bieden van efficiënte en hoogwaardige service. Alle medewerkers blijven zich voortdurend bijscholen en er is veel aandacht voor innovatie.
Het TDC werkt volgens internationale richtlijnen (Good Clinical Practice) en wat data betreft volgens de FAIR principes (Findable, Accessible, Interoperable, Reusable). De kwaliteit wordt geborgd met een eigen kwaliteitsmanagementsysteem en Standard Operating Procedures (SOP’s). Verder speelt het TDC een actieve rol in de integratie van onderzoek en zorg en werkt samen met internationale partners.
Alle onderzoeksvoorstellen waarbij patiënten van het Máxima, hun gegevens en/of materiaal betrokken zijn worden beoordeeld door de Scientific Committee (SciCom), bestaande uit de Clinical Research Committee (CRC) en de Biobank and Data Access Committee (BDAC).
De leiding van het TDC is in handen van Prof. Dr. Michel Zwaan (kinderoncoloog) en Dr. Harm van Tinteren (statisticus), met ondersteuning van manager bedrijfsvoering Steven Vanhoutvin en teamleiders Edith Schasfoort (site), Karolien Makkink (trialmanagement) en Rinke Riezebos (datamanagement).
Het site team houdt zich bezig met de uitvoering van alle studies waarvoor patiënten worden gerekruteerd in het Maxima. Dit omvat zowel studies geïnitieerd door onderzoekers in academische centra als studies opgezet door farmaceutische bedrijven.
Trial management houdt zich bezig met het opzetten en coördineren van de door onderzoekers geïnitieerde studies die zowel lokaal als internationaal uitgevoerd worden door deelnemende centra over de hele wereld. Trial managers werken intensief samen met de onderzoekers en verzorgen ‘end-to-end’ procesmanagement van clinical trials, en worden hierbij ondersteund door clinical trial assistants.
Afhankelijk van het type onderzoek is trial management verantwoordelijk voor o.a.:
Voor de start:
Tijdens de studie:
Binnen het TDC is het team Clinical Data Provisioning verantwoordelijk voor de verwerking en uitlevering van data ten behoeve van onderzoek en kwaliteit.
Het team bestaat uit verschillende sub-teams met ieder een eigen taak:
Ondersteuning bij alle fases van prospectief klinisch onderzoek, van opzet tot finale analyse
Al het klinisch onderzoek dient uitgevoerd te worden volgens de geldende wet- en regelgeving, o.a. ‘Good Clinical Practice’ (GCP). Met regelmaat wordt hierop geaudit. De kwaliteitsmedewerkers zijn verantwoordelijk voor het kwaliteitsmanagementsysteem van de afdeling. Ook ontwikkelen en geven ze de centrumspecifieke bijeenkomst van de BROK®-cursus (Basiscursus Regelgeving en Organisatie voor Klinisch Onderzoekers) voor alle bij het klinisch onderzoek betrokken medewerkers.
Het Business Operations team is verantwoordelijk voor het budgetteren van studies en het opstellen en completeren van alle studiegerelateerde contracten. Ze maken afspraken en onderhouden contracten met farmaceutische bedrijven en andere toeleveranciers (software bedrijven etc). Voor additionele juridische ondersteuning stuurt het TDC je vraag door naar het Knowledge Transfer Office (KTO).